Міністерство Освіти і Науки України
Чернівецький національний університет
імені Ю.Федьковича
Біологічний факультет
Кафедра біохімії і експериментальної екології
АДЛЕР ВІКТОРІЯ ФРАНКІВНА
ДИПЛОМНА РОБОТА
Динаміка біохімічних показників крові,
розподіл хворих за віком і статтю в
залежності від форми гемобластозу
Науковий керівник, Соколова В.М.
к.б.н., доцент
Допущено до захисту “____” грудня 2000 р.
Завідувач кафедри біохімії і Костишин С.С.
експериментальної екології,
д.б.н., професор
Чернівці 2000
АНОТАЦІЯ
Дана дипломна робота виконана в лабораторних умовах клінічної лабораторії Коломийського онкодиспансеру.
Проведені дослідження мали на меті вивчення особливостей патологічного впливу гострого і хронічного лейкозів на систему кровотворення організму людини і на динаміку показників стану гемопоезу.
В результаті досліджень встановлено характер зміни основних біохімічних показників периферійної крові хворих гемобластозами, особливості їх розподілу за віком і статтю.
Виявлено прогностичні фактори в перебігу і розвитку різних варіантів лейкозу, динаміку клініко-морфологічних проявів і смертності в залежності від форми захворювання.
ЗМІСТ
ВСТУП ........................................................................................................ 4
І. ОГЛЯД ЛІТЕРАТУРИ.
Аналіз теорій походження, етіології і патогенезу
лейкозів, як злоякісних захворювань кровотворних органів....... 6
Специфіка клініко-гематологічної картини
гострого лейкозу, прогностичні фактори в його розвитку
і перебігу...........................................................................................12
Динаміка клінічних і гематологічних
показників при лімфобластному і мієлобластному
варіантах гострого лейкозу........................................................... 19
Патогенетичні, клінічні і морфологічні
характеристики хронічного лімфолейкозу…....................... 24
1.5. Особливості проявів хронічного мієлолейкозу в
клітинах кісткового мозку і периферійній крові.…........... 30
ІІ. МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕНЬ.
2.1. Умови, об’єкти і методика експерименту.............................. 34
ІІІ. РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯ.
3.1. Визначення характеру розподілу хворих за віком і
статтю в залежності від форми лейкозу......................................... 38
3.2. Зміна основних біохімічних показників крові в
залежності від форми і ступеня важкості захворювання............. 40
3.3. Зміна біохімічних показників крові хворих
хронічним мієлолейкозом в залежності від статі.......................... 43
3.4. Розподіл померлих по характеру захворювання
і віку................................................................................................... 46
3.5. Визначення середнього арифметичного показника
виживання груп хворих гострим лімфобластним і
гострим мієлобластним варіантами лейкозу................................ 48
ВИСНОВКИ ............................................................................................... 51
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ............................................ 52
ВСТУП
Гемобластози – новоутворення, які розвиваються з клітин кровотворної тканини. До гемобластозів відносять лейкози. Лейкози займають перше місце серед інших захворювань системи крові [38]. Ця група захворювань має велике соціальне значення, бо смертність від них складає близько 6-10% дорослих, що гинуть від злоякісних новоутворень і близько 50% дітей. В останньому випадку це пов’язано з піком захворюваності в ранньому дитячому віці, обумовленому в основному гострими лейкозами. Смертність від лейкозів складає біля 1% загальної смертності по всім країнам світу [7].
Лейкози – важлива проблема сучасної біології і медицини. Серед злоякісних новоутворень їм належить особлива і першочергова роль. Це пов’язано з тим, що лейкози залишаються фатальним захворюванням, яке поражує в усе зростаючому масштабі людину і тварин. Лейкоз виявився “точкою росту” всієї проблеми раку в цілому, і успіхи в вивченні лейкозів і боротьби з ними можуть бути поширені на інші форми злоякісних пухлин. Не випадково тому в міжнародній співпраці вчених лейкози вибрані одним з центральних об’єктів досліджень [28].
Проблема лейкозів є однією з невирішених проблем сучасної медичної науки. За останні роки спостерігається збільшення розповсюдження гемобластозів, що обумовлено як тенденцією до росту захворюваності, так і збільшенням тривалості життя ряду категорій лейкозних хворих в результаті терапії [23].
Також в даний час проблема лейкозів набула актуального значення в зв’язку з постійним ростом захворюваності, недостатністю відомостей про етіологію, патогенез і малою ефективністю існуючих методів лікування. Аналіз захворюваності лейкозами виявляє ряд цікавих даних: безсумнівне і повсемісне підвищення загальної захворюваності лейкозами за останні десятиріччя. особливо різке підвищення захворюваності людей старших вікових груп, більш висока захворюваність чоловіків, зв’язок захворюваності лейкозами з расовою приналежністю. Вплив іонізуючої радіації на частоту виникнення лейкозів був встановлений при аналізі наслідків аварії на Чорнобильській АЕС, наслідків атомного бомбардування Хіросіми і Нагасакі, а також у хворих, лікованих опроміненням. Іонізуюча радіація викликає в основному гострі лейкози і хронічний мієлолейкоз [29]. Наслідки аварії на Чорнобильській АЕС показали, що частота виникнення лейкозів прямо пропорційна дозі опромінення. Малі дози опромінення, які використовуються в медицині з діагностичною метою, не впливають на частоту розвитку лейкозів [27].
За даними деяких авторів, в останні роки після аварії на Чорнобильській АЕС спостерігається підвищення смертності від онкологічних захворювань крові [27], а також збільшення відсотка смертності внаслідок хвороб кровотворних органів серед дітей [37].
Серед населення Північної і Північно-Східної Європи (Норвегія, Швеція, Фінляндія, Данія), в Канаді, США, Ізраїлі стандартизовані показники захворюваності гемобластозами чоловічого населення складають 7-10,7 випадків, а жіночого – 5-7 випадків на 100 000 населення. Серед гемобластозів перше місце займають гострі лейкози (29,1%). Хронічний лімфолейкоз часто зустрічається серед населення європейських країн, Канади, США (від 15 до 40% всіх випадків лейкозів). Високі показники захворюваності цією формою лейкозу відмічені в Прибалтиці, а в Середній Азії вони значно нижчі [24].
Після тривалого періоду повної безпорадності, коли для лікування лейкозних хворих використовувалися симптоматичні і неефективні лікарські засоби, в даний час зусиллями багатьох вчених створені препарати і методи лікування, що дозволяють отримувати об’єктивний клінічний і гематологічний ефект, в ряді випадків повні ремісії і реальне збільшення тривалості життя хворих гемобластозами [41].
І. ОГЛЯД ЛІТЕРАТУРИ
Аналіз теорій походження, етіології і патогенезу лейкозів, як злоякісних захворювань кровотворних органів.
До злоякісних новоутворень відносять гемобластози – група пухлин, що виникає із кровотворних клітин [2].
Терміном “гемобластози” об’єднують групу захворювань різноманітного характеру. Одні з них (ретикулосаркоми, лімфосаркоми) близько нагадують справжні пухлини, інші (лейкози), здавалось би, мають з ними мало спільного. Така своєрідність гемобластозів пояснюється анатомо-фізіологічними особливостями тієї тканини, з якої виникають ці новоутворення. Кровотворна тканина практично не утворює анатомічно обособлених органів, а розміщується в організмі дифузно. Але в фізіологічному відношенні вона являє собою істинний орган, який єдино образно реагує на різні зовнішні впливи (еритробластична реакція кісткового мозку при крововтраті) [14].
Всі гемобластози поділяються на дві основні групи. Процеси першої групи – лейкози відрізняються переважним ураженням основного компонента кровотворної тканини – кісткового мозку і тому, як правило, супроводжуються характерними змінами крові. Для процесів другої групи – гематосарком – характерна наявність на початковому етапі розвитку, утворення вогнищевих пухлинних розростань елементів кровотворної тканини без ураження кісткового мозку і типових змін картини крові.
Відмінність між лейкозами і гематосаркомами не є абсолютною. Більш того, процеси обидвох груп пов’язані різними перехідними станами і можливістю взаємних переходів. Так, відомо, що при лейкозах можуть розвиватися пухлинні розростання, наприклад, в лімфатичних вузлах, плеврі і інших тканинах. Часто зустрічаються лейкози, при яких кісткове кровотворення може під впливом лікування нормалізуватися і основним проявом залишаються позакістковомозкові пухлинні розростання (наприклад, ураження мозкових оболонок при гострому лейкозі – нейролейкемія). В той же час гематосаркоми, які звичайно починаються з появи одного чи кількох пухлинних вузлів, можуть піддаватися генералізації (гематосаркоматоз) чи, при втягненні в патологічний процес кісткового мозку, лейкемізації, що характеризується змінами крові, типовими для звичайних лейкозів [10].
Гематобластози мають ряд загальних рис: перш за все, своєрідна “системність” ураження, яка зумовлена раннім метастазуванням пухлинних клітин в органи кровотворення. Наступна загальна риса – пригнічення нормального кровотворення і, в першу чергу, ростка, що послужив джерелом пухлинного росту [29].
Лейкози – це пухлини кровотворних клітин, які характеризуються глибоким порушенням ровотворення, що виражається в неправильній патологічній регенерації клітин крові. Вони відносяться до злоякісних захворювань кровотворних органів [40].
Етіологія лейкозів остаточно не вияснена. Самими першими були визначені три теорії походження лейкозів:
Інфекційна теорія.
Пухлинна теорія.
Теорія системно-проліферативної природи лейкозів.
Прихильники інфекційної теорії поділилися на три групи: одні рахують, що збудниками лейкозу можуть бути різні мікроби, які викликають однотипну реакцію зі сторони крові, другі відстоюють точку зору туберкульозної етіології лейкозу, на кінець треті, притримуються вірусної теорії лейкозу.
Прибічником інфекційної теорії походження лейкозу був Д.Н.Яновський (1962), який рахував, що лейкоз – це своєрідна алергічна реакція, що виникає у відповідь на різноманітні інфекційні процеси. Таким чином, він до певного ступеню наближував лейкози до лейкомоїдних реакцій. Однак, для лейкозу, на відміну від лейкемоїдних реакцій, характерна системність ураження кровотворної тканини і незворотність процесу, тоді як лейкемоїдна реакція зникає при ліквідації патогенного фактора, який її викликав. Опротестуванням інфекційної теорії являється відсутність контагіозності лейкозів і неможливість передачі захворювання при неодноразових переливаннях крові хворого лейкозом здоровим людям.
Деякі вчені рахували, що збудник лейкозу – туберкульозна паличка, тому що у деяких хворих спостерігається поєднання лейкозу з туберкульозом. Але в даний час безперечно встановлено, що в “беззахисному” організмі хворого лейкозом створюються сприятливі умови для ендогенної реінфекції туберкульозу. Отже, туберкульоз є не першопричиною лейкозу, а його наслідком [10].
Прибічники вірусної теорії (Еллерман, Банг, Гросс, В.М.Бергольц) рахували, що цей агент, на відміну від інших вірусів, знаходиться в здоровому організмі в латентному стані і здатний передаватися по спадковості. Однак, не дивлячись на те, що вірусна природа лейкозів доказана в експерименті і виділені навіть певні штами вірусу, все ж вірусна етіологія походження лейкозів у людини до даного часу не встановлена [39].
Найбільш обґрунтованою і доказовою є пухлинна теорія, яка підтримується більшістю авторів. Для підтвердження даної концепції приведені слідуючі доводи:
Нестримна проліферація кровотворної тканини, патологічні елементи якої характеризуються аномалією клітинного поділу, клітинним поліморфізмом і хімічною анаплазією.
Наявність пухлино подібних розростань.
Поєднання лейкозу з іншими злоякісними новоутвореннями, що найчастіше спостерігається при хронічному лімфолейкозі.
Характер метаболізму лейкемічної тканини ідентичний такому самому як при пухлинах.
Лейкози характеризуються, на відміну від злоякісних пухли, системністю ураження функціонально пов’язаних між собою кровотворних органів, відсутністю метастазування і циклічним перебігом [29].
Третя теорія походження лейкозів – системно-проліферативна – розглядається, як дещо подібна з пухлинною. Вона розглядає патологічний процес, як наслідок порушення патогенетичних механізмів, що регулюють проліферацію і дозрівання елементів крові. Причиною цих порушень вважають різні екзогенні і ендогенні фактори.
До екзогенних факторів відносять патогенний вплив вірусів, канцерогенні речовини і іонізуючу радіацію. Для доказу зв’язку лейкозів з радіацією приводять слідуючи факти:
більш частий розвиток лейкозів у людей, які піддаються довготривалому опроміненню внаслідок специфіки своєї професії;
підвищена захворюваність лейкозами серед населення після аварії на Чорнобильській АЕС та в Японії;
збільшення випадків лейкозу у хворих, які отримували рентгено- чи радіоізотопну терапію при різних захворюваннях.
До ендогенних факторів можна віднести вплив ендокринних порушень в організмі. Доказом може служити частий розвиток гострого лейкозу в період статевого дозрівання організму і хронічного лімфоденозу – при настанні клімаксу [12].
Сучасні дослідження показали, що лейкози в залежності від причин, що їх викликають, поділяються на дві групи. Одна група виникає під впливом очевидних мутагенів.
Друга група: хронічний лімфолейкоз – не провокується мутагенами, часто носить спадковий характер.
1. Роль іонізуючої радіації. Збільшення частоти хронічного мієлолейкозу, гострих лейкозів від дії іонізуючої радіації виявлено в Японії, найбільш вразливі вікові групи до 9 років і старше 30 років. Виявлений вплив опромінення на розвиток лейкозу при лікуванні лімфогранулематозу, раку. Йдеться про рентгеноопромінення, а також вплив ізотопів радіоактивного фосфору, радіоактивного йоду, стронцію, цезію. В бластних клітинах знаходили кільцеву хромосому – ознака радіаційного хромосомного пошкодження.
Під впливом опромінення гострий лімфолейкоз частіше виникає у віці до 19 років, гострий мієлобластний і хронічний мієлолейкоз у віці 30-44 років.
2. Роль хімічних мутагенів. Підвищення частоти лейкозів серед осіб, на яких діє бензол, відоме давно. Особливо мутагеннадія хімічних факторів стала проявлятись при лікуванні хронічних лейкозів, мієломної хвороби, ревматоїдного артриту цитостатиками. У цих пацієнтів через певний час може розвиватися гострий лейкоз. Це такі препарати, як азотіоприн, лейкеран, циклофосфан, навіть левоміцетин, бутадіон.
3. Роль вірусів. В процесів вивчення ролі вірусів у виникненні лейкозів виявлені вірусні онкогени – гени, які здатні примусити клітину безперервно проліферувати після вмонтування в ген клітини. Роль вірусу можна пояснити лише як фактор мутагенності.
4. Роль спадковості. Лейкоз може частіше виникати в сім’ях, де зареєстровані генетичні дефекти зі змінами або без змін хромосом. Хронічний мієлолейкоз – поки що єдина форма лейкозу, при якій достовірно встановлено постійні і специфічні зміни в каріотипі. Ці зміни полягають у втраті однією (22-ю) хромосомою приблизно половини своєї маси, у зв’язку з чим в хромосомному комплексі цих хворих є одна атипова, майже вдвоє зменшена хромосома. Її описали в 1960 р. філадельфійські вчені і вона отримала назву Філадельфійської (‘Ph) хромосоми.
Таким чином, до гострих мієлолейкозів ведуть спадкові хвороби, що супроводжуються нестабільністю генотипу [29].
Посилено розвивається клонова теорія виникнення лейкозів. Згідно цієї теорії в основі лейкозів лежить хромосомна мутація в певній кровотворній клітині з наступним її розмноженням і утворенням клону патологічних клітин, які піддаються бластомній трансформації і невтримній клітинній проліферації. Клонова теорія або теорія “патологічного клону” являє інтерес з точки зору можливості розвитку вроджених лейкозів, а також сімейного лейкозу, при яких розвиваються мутації з появою нових спадкових властивостей [24].
В даний час доведено, що хронічний лімфолейкоз не провокується зовнішніми факторами, передається по спадковості як за рецесивним, так і за домінантним типом, в його розвитку мають значення етнічні особливості [25].
Допускають, що мутації проходять безперервно, але фагоцитоз та захисні сили організму знищують мутантів. Для розвитку лейкозу чи пухлини необхідне приєднання мутації клітин та ослаблення імунного захисту. Подальше поширення лейкозу здійснюється метастазуванням клітин по кровотворній системі. Родоначальником лейкозного процесу частіше є клітини 1-го чи 2-го клону кровотворення.
Друга патогенетична особливість – поступове озлоякіснення пухлинного процесу – “пухлинна прогресія”, тобто моноклонова стадія змінюється поліклоновою [29].
При лейкозах ураження строми створює умови для пухлинного росту клітин. Патологія розвитку клітин супроводжується змінами їх біологічних властивостей [28].
При лейкозах існують ті ж біологічні закони, які підтримують життєдіяльність організму, але в “збоченому” вигляді, оскільки при лейкозах клітинні маси в багато раз перевищують свій нормальний і навіть реактивний рівень [1]. Крім того, збільшення маси клітин відбувається в умовах недостатності кістково мозкового кровотворення, яка в тому чи іншому ступені має місце при лейкозах [35].
Специфіка клініко-гематологічної картини гострого лейкозу, прогностичні фактори в його розвитку і перебігу.
До гострих відносять лейкози. при яких основна маса пухлинних клітин представлена молодими клітинами-бластами. Гострий лейкоз в хронічний не переходить, а хронічні лейкози навпаки, в термінальній стадії набувають рис гострих – бластні кризи [29].
Гострі лейкози поширені повсемісно, в різних країнах. На їх долю припадає від 40 до 90% всіх випадків лейкозів. Чоловіки і жінки хворіють з однаковою частотою. Гострі лейкози зустрічаються в усіх вікових групах, але у дітей і людей старшого віку – найчастіше серед усіх гемобластозів.
У дорослих 80% гострих лейкозів складають мієлобластний і мієломонобластний варіанти, у дітей до 90% випадків припадає на гострий лімфобластний лейкоз [16].
Гострий лейкоз – це неконтрольована проліферація клітин білої крові на ранніх стадіях дозрівання. Визначається при наявності більше 30% бластних клітин в мазку кісткового мозку [22].
Початковий період гострого лейкозу характеризується або безсимптомним періодом, або загальною слабкістю, недомаганням, болями в кістках і суглобах, субфебрильною температурою і ці симптоми поступово розвиваються. Лише через декілька тижнів з’являються характерні ознаки хвороби. В інших випадках захворювання виникає раптово з ангіни чи гострого геморагічного діатезу на фоні високої температури.
В подальшому гострий лейкоз розвивається бурними темпами з швидким наростанням основних симптомів – прогресуючої анемії, розгорнутої картини геморагічного діатезу, виснажливої лихоманки і виразково-некротичних процесів в порожнині рота і зіву [10]. Характерна для початкового періоду катаральна ангіна дуже швидко переходить в некротичну, з’являється виразковий стоматит, іноді некротично-запальний процес поширюється на слизову твердого і м’якого піднебіння, надгортанник і навіть трахею. Турбує біль в кістках і суглобах, іноді зубний біль, рихлість і кровоточивість ясен [33].
При об’єктивному обстеженні хворого звертає увагу блідість шкіри і видимих слизових оболонок. Геморагічні прояви в більшості носять характер обширних крововиливів в шкіру і підшкірну клітковину, чи профузних кровотеч з слизових оболонок. Можливі також субкон’юнктивальні крововиливи в сітківку ока і головний мозок. Рідше спостерігаються точкові геморагії на шкрі і слизових оболонках. В виникненні геморагічного діатезу основна роль належить тромбоцитопенії. Разом з цим має значення ураження судинної стінки, обумовлене лейкемічною інфільтрацією останньої, а також порушення коагуляційних властивостей крові, що в сукупності визначає важкість геморагічних проявів при гострому лейкозі [18].
Частими (особливо у дітей) є різноманітні ознаки ураження нервової системи – головні болі, головокружіння, симптоми подраження мозкових оболонок, ураження окремих черепно-мозкових нервів [10].
Внаслідок глибоких дистрофічних змін в міокарді серце збільшене в розмірах, пульс частий і малий, артеріальний тиск різко понижений. На електрокардіограмі спостерігаються ознаки вогнищевого ураження міокарду [7]. Іноді розвивається сухий чи ексудативний плеврит, виникає пневмонія, на фоні якої можливе грибкове ураження – кандідомікоз, вогнища некрозу чи лейкемічної інфільтрації в легеневій паренхімі. На фоні лейкозного процесу може розвинутись туберкульоз [22].
Розміри лімфатичних вузлів, печінки і селезінки можуть залишатися нормальними чи нерізко збільшуються. Гіпертрофія цих органів частіше спостерігається у дітей.
Збільшення цих органів обумовлено лейкемічною метаплазією, в початкових стадіях гострого лейкозу незначне і непостійне, так як ступінь розвитку метаплазії в органах залежить в основному від тривалості протікання патологічного процесу. Тільки в більш пізніх стадіях, особливо при затяжному перебігу лейкемічного процесу всі ці органи щільні і неболючі [24].
Однак спостерігаються пухлино подібні форми гострого лейкозу (приблизно до 10% всіх випадків), які з самих ранніх стадій захворювання характеризуються розростанням лейкемічних вогнищ в різних органах: лімфатичних вузлах, селезінці, сітківці ока, наприклад, при хлорлейкозі (орбітальні пухлини – хлорома), що іноді служить приводом до помилкової діагностики злоякісного новоутворення [39].
В залежності від переваги в клінічній картині окремих симптомів захворювання виділяють декілька клінічних варіантів гострого лейкозу – анемічний, виразково-некротичний, геморагічний, септичний, пухлино подібний і змішаний. Однак такий поділ є умовним, бо в більшості випадків рано чи пізно клінічні прояви стають різноманітними і хворі гинуть при розгорнутій картині лейкозу [34].
По клінічному перебігу гострого лейкозу виділяють 3 варіанти хвороби: блискавичну форму (з тривалістю перебігу не більше 1 міс.); з гострим перебігом – до 6 міс. і з затяжним перебігом – від півроку до 2 років і більше [16, 42].
Термінальна стадія хвороби характеризується прогресуванням основних симптомів захворювання, пов’язаних з різким пригніченням нормальних ростків кровотворення. На місцях крововиливів, в зв’язку з глибоким порушенням трофіки виникають некрози, які ускладнюються вторинною інфекцією. Прогресує септицемія і загальна інтоксикація організму. В цьому періоді захворювання температура різко підвищується до 39-40оС, випереджаючи нерідко появу інших симптомів. характерних для кінцевого періоду – різкої слабості, адинамії, порушень діяльності шлунково-кишкового тракту, упадку серцево-судинної діяльності. Також в термінальній стадії виникають вогнища саркомного росту в шкірі, міокарді, нирках [39].
В основі паталогоаналітичної картини лейкозів лежить надлишкове розростання патологічної лейкемічної тканини. Воно відмічається в основному в кровотворних органах – кістковому мозку, печінці, селезінці, лімфатичних вузлах і практично не існує ні одного органа, в якому не могли б локалізуватися лімфатичні інфільтрати. Крім лейкеміних інфільтратів в формуванні патологоанатомічної картини лейкозів приймають участь і вторинні зміни у вигляді анемій, геморагій, інфекційно-некротичних вогнищ [3].
Розростання лейкемічної тканини займає як кровотворний, так і жировий кістковий мозок. Колір кісткового мозку змінюється, - він стає сіруватим, сіро-зеленим (“піоїдним”) при хронічному лейкозі і сіро-червоним – при гострому лейкозі. Кістковий каркас піддається помірному розсмоктуванню [2].
Картина крові при гострих лейкозах має певні особливості:
Поява в лейкограмі недиференційованих клітинних елементів – бластних клітин (гемоцитобластів, мієлобластів, ретикулярних клітин), що складають основну масу клітин. Число їх може коливатися від поодиноких елементів в формулі до тотального бластного складу.
Наявність лейкемічного провалу, який виражається в відсутності проміжних форм між недиференційованими клітинами (гемоцитобластами) і зрілими нейтрофілами в зв’язку з припиненням дозрівання кров’яних елементів на стадії материнської кров’яної клітини.
Відсутність в лейкоцитарній формулі еозинофілів і базофілів, що при наявності лейкемічного провалу дає можливість диференціювати гострий лейкоз від хронічного мієлолейкозу, якому властива еозинофільно-базофільна асоціація і збереження переходу від “бластних” елементів до зрілих нейтрофілів, тобто наявність мієлоцитів, метомієлоцитів і інших.
Різко виражена анемія, яка є барометром важкості перебігу лейкемчного процесу, і тромбоцитопенія (часто нижче критичного рівня), розвиток яких пов’язаний з проліферацією недиференційованих елементів, які втратили здатність до дозрівання. Анемія сягає переважно крайніх ступенів – вміст гемоглобіну падає до 20-30% [15].
Часто при гострих лейкозах в крові зустрічаються поодинокі еритрокаріоцити. вони мають суттєве діагностичне значення, бо характерні саме для гострого лейкозу і пов’язані з бластною інфільтрацією кісткового мозку.
ШОЕ при гострих лейкозах переважно збільшена [3].
Загальна кількість лейкоцитів коливається в великих межах – від низьких (лейкопенічна форма) до значно підвищених цифр. Лейкопенія спостерігається при поєднанні гострого лейкозу з туберкульозом, який пригнічує лейкопоез [6].
Спостерігається значне погіршення перебігу гострого лейкозу при вагітності. Негативним є вплив не стільки самої вагітності, скільки родів, після яких завжди спостерігається значне погіршення перебігу гострого лейкозу і смерть на протязі 1-го тижня після родів у 25% жінок [42].
Гострий лейкоз у дітей раннього віку має несприятливий прогноз. Це пояснюється рядом таких факторів, як гіперлейкоцитоз за рахунок бластних клітин, що складають значну пухлинну масу, багаточисельних порушень в хромосомах бластних клітин за рахунок перебудови ділянок хромосом, що спостерігається у 75% дітей в віці до 1 року [6].
Середня тривалість життя хворих гострим лейкозом при сучасній терапії складає 15-18 міс., хоча окремі хворі залишаються в ремісії декілька років, особливо низька тривалість життя у хворих похилого віку [31].
Незважаючи на успіхи досягнуті в лікуванні гострих лейкозів, смертність хворих залишається високою [32]. Прогноз в усіх випадках залишається несприятливим. Смерть обумовлена загостренням і прогресування лейкозного процесу [10].
20 % хворих гинуть від профузної кровотечі чи обширного крововиливу в мозок. Виникає аутоінтоксикація, пов’язана з масовою загибеллю лейкоцитів і наводненням організму продуктами розпаду нуклеїнових сполук, що на ряду з анемією приводить до розвитку незворотніх дистрофічних змін в різних органах і тканинах. Іншими причинами смерті є пневмонії і прогресуюча серцево-судинна недостатність [13].
При всіх варіантах гострого лейкозу прогностично несприятливими рахують слідуючі симптоми: ранню тромбоцитопенію, високий лейкоцитоз (більше 2х107 ), велике число бластних клітин (більше 75%) в кістковому мозку; похилий вік хворого.
При гострому лейкозі число лейкоцитів збільшене ніж у половини хворих, однак у 15% хворих воно незмінене, а у 33% спостерігається нейтропенія. Наявність бластів в периферійній крові характерна для 85% хворих. Більше 80% мають також анемію чи тромбоцитопенію. Тромбоцитопенія присутня практично завжди, а значна (<50x109/л) більше 50% випадків [38].
Більшість вітчизняних і зарубіжних гематологів класифікують гострі лейкози відповідно до сучасних уявлень про кровотворення на дві великі групи: мієлоїдну і лімфоїдну.
До першої групи відносять гострий мієлобластний лейкоз з його субваріантами: мієломонобластним, промієлоцитарним, монобластним і еритробластним.
До другої групи включені гострий лімфобластний лейкоз і гострий недиференційований лейкоз.
Дана класифікація створена на основі цитологічних і цитохімічних особливостей бластних клітин [29].
Найбільш характерна особливість, властива типовим формам гострого лейкозу – це поява в крові родоначальних клітин: гемоцитобластів, мієлобластів, лімфобластів. Але бластоз кісткового мозку не завжди супроводжується виходом бластів в кров. Клітинний склад кісткового мозку і периферійної крові повної аналогії не має. На початку хвороби кількість бластів в пункт аті кісткового мозку може складати 10-20%, а по мірі розвитку тотальної бластної інфільтрації – до 98-100% [13].
Динаміка клінічних і гематологічних показників при лімфобластному і мієлобластному варіантах гострого лейкозу.
В 1964 році в Кембриджі була визначена цитохімічна характеристика кожної з форм гострого лейкозу [Hayhoc et. al., 1964], яка дала можливість їх класифікувати [22].
Гострий мієлобластний лейкоз (ГМЛ) – найбільш частий серед дорослих варіант гострого лейкозу, який дебютує чи симптомами недостатності кровотворення (тромбоцитопенічний синдром, явища гранулоцитопенії), чи виявляється при випадковому дослідженні крові [38].
В даний час ГМЛ розглядається як злоякісна проліферація кровотворних клітин, що виникає внаслідок соматичної мутації в одній стовбуровій клітині, нащадки якої формують лейкемічний клон. Необхідною умовою розвитку лейкемічного клону є порушення процесів клітинної диференціації і проліферації з накопиченням недозрілих форм кровотворних клітин [5].
ГМЛ виявляється у 50-60% хворих. Вік майже половини хворих перевищує 40 років. Даний варіант гострого лейкозу характеризується прогресивним перебігом, вираженого інтоксикацією і клінічною декомпенсацією процесу, яка наступає дуже швидко: виражена анемія і тромбоцитопенія з геморагічними проявами, виразково-некротичне ураження шкіри і слизових. Нерідко відмічається гіперплазія ясен і мигдаликів (у 10% хворих); печінка і селезінка збільшуються в різному ступені і непостійно, лімфатичні вузли гіперплазовані у половини хворих [3].
В периферійній крові, на відміну від лімфобластного типу лейкозу, нерідко з моменту появи бластних клітин відмічається в тому чи іншому ступені пригнічення кровотворення: помірна анемія, тромбоцитопенія [15]. Число лейкоцитів коливається в широких межах. алейкемічні форми зустрічаються рідко (16%). Основну масу в кістковому мозку складають бластні клітини. У більшості хворих відсоток бластних клітин складає 50-60 в гематограмі і 80-90 в пунктаті кісткового мозку [38].
Цей варіант лейкозу характеризується малою вираженістю поза кісткової інфільтрації [10]. Як правило, виявляється лейкозна інфільтрація в селезінці, печінці. легенях і інших органах. Лейкозна інфільтрація печінки і дистрофічні зміни органу приводять нерідко до печінкової недостатності, що є безпосередньою причиною смерті у 11% хворих ГМЛ. Причинами смерті при ГМЛ можуть бути також пневмонії (43%), прогресування лейкозу (24%), геморагії (20%). Середня тривалість життя хворих ГМЛ складає 8,21,3 міс., що вдвічі менше, ніж при гострому лімфобластному лейкозі [5].
Перебіг ГМЛ більш злоякісний, ніж ГЛЛ, ремісії досягаються рідше. В середньому, частота повних ремісій при ГМЛ коливається від 30 до 50%. Апластична анемія в випадку досягнення ремісії переходить в ГМЛ [24].
Мієломонобластний тип гострого лейкозу – являється субваріантом ГМЛ, який зустрічається від 28-80%. Середній вік хворих старший, ніж при ГМЛ [23]. Переважають симптоми, обумовлені пригніченням нормальних ростків кровотворення. Характеризується більш вираженими симптомами інтоксикації і клінічної декомпенсації у всіх хворих, сильною анемією, геморагічним діатезом, частими виразково-некротичними змінами шкіри і слизових, різкою гіперплазією ясен і мигдаликів [31]. Для лейкозу мієломонобластиного типу характерна наявність двох різновидностей бластних клітин, що нагадує мієлобласти і моноцити. Тривалість життя хворих значно коротша, ніж при ГМЛ. Ця різновидність гострого лейкозу більш резистентна до терапії і рідше дає ремісії, ніж ГМЛ. Так само проявляється і монобластичний тип гострого лейкозу [35].
Промієлоцитарний тип гострого лейкозу відрізняється різкою злоякісністю перебігу і швидким наростанням патологічної симптоматики, важкою інтоксикацією, високою температурою, глибокою анемією, інтенсивними геморагічними проявами, які частіше всього служать причиною смерті через 1-1,5 міс. від початку захворювання. Ремісії досягаються у 60% хворих [22]. Бластні клітини в гематограмі і мієлограмі складають 50-60%[3].
Еритромієлоз – субваріант ГМЛ. Зустрічається рідко в 1-2% випадків. Частіше всього початок хвороби характеризується анемічним синдромом [5]. В мієлограмі виявляється збільшення клітин червоного ряду. Бластні елементи представлені двома клітинними формами – мієлобластами і еритронормобластами. В крові нараховується від 20-80% еритронормобластів [2]. Повна ремісія рідко досягається при цьому варіанті гострого лейкозу, але захворювання не відрізняється швидким прогресуванням і середня тривалість життя у 20% хворих складає біля 18 міс. (Ellison, 1973) [10].
Гострий лімфобластний лейкоз (ГЛЛ) по сучасним уявленням розглядається як клональна проліферація недозрілих лімфопатичних попередників, які на морфологічному рівні розпізнаються як лейкемічні лімфобласти [4].
ГЛЛ зустрічається в 5 разів частіше в дитячому віці: частота його у дітей складає 80%, у дорослих – 15%, переважає в юнацькому віці. По клінічним проявам, чутливості до терапії їх перебігу виділяють дитячий (до 25 років) і дорослий варіант ГЛЛ. ГЛЛ характеризуються помірно прогресуючим перебігом захворювання, збереженням відносно задовільного стану і самопочуття хворих [26]. Особливість клінічної картини проявляється в збільшенні лімфатичних вузлів, селезінки, печінки і метастазування в яєчки і мозкові оболонки. Розвиток нейролейкемії наступає переважно при ГЛЛ, частота її у дітей досягає 65%. позакістковомозкові метастази при цій формі лейкозу мають суттєво кращий прогноз, ніж при мієлобластному. У пацієнтів старше 20-25 років відмінності між лімфобластним і мієлобластним гострим лейкозом поступово стираються [30].
Геморагічні прояви у вигляді дрібноточкових і плямистих шкірних крововиливів спостерігаються майже у половини хворих, однак лише в одиничних випадках геморагічний синдром домінує в вигляді маткових, носових і кишечник кровотеч, до крововиливу в мозок [14].
Виразково-некротичні зміни шкіри і слизових оболонок, гіперплазія ясен і мигдаликів при ГЛЛ спостерігаються значно рідше, ніж при інших варіантах гострого лейкозу. ГЛЛ відрізняється частотою специфічних неврологічних проявів, що спостерігаються у 23% хворих [17].
При ГЛЛ в крові виявляється анемія, однак ступінь анемізації помірний, тромбоцитопенія, нормальний рівень лейкоцитів [9].
Діагноз виставляється на основі виявлення характерних лейкемічних клітин в периферійній крові і кістковому мозку. Як правило, при ГЛЛ виражена бластна трансформація кісткового мозку [2].
Оскільки ГЛЛ найчастіше зустрічається у дітей, більше відомостей є про прогностичні фактори у дітей, ніж у дорослих. Хоча на проноз впливає багато факторів, найбільш важливі у дітей – це вік, кількість лейкоцитів, цитогенетика і відповідь на початкову терапію. У дорослих важливу роль відіграють кількість лейкоцитів, цитогенетика і відповідь на хіміотерапію, а також фактори, пов’язані з можливостями пацієнта перенести хіміотерапію – такі, як вік і загальних стан [36].
ГЛЛ у дорослих має більш важкий перебіг з меншим відсотком отримання клініко-гематологічної ремісії [32].
Факторами поганого прогнозу при ГЛЛ є: - вік старше 10 років, - лейкоцитоз (< 15 000), - чоловіча стать, - наявність Філадельфійської хромосоми, - лейкемічне ураження ЦНС [38]. Практичне значення діагностики і класифікації ГЛЛ обмежується необхідністю виділення груп пацієнтів, що потребують однакової терапії [8].
Правильно проведена на всіх етапах захворювання цитостатична терапія дає найбільше число ремісій при ГЛЛ. Повна клініко-гематологічна ремісія спостерігається у 65-70% хворих, що вдвічі більше, ніж при лікуванні ГМЛ [22].
У дітей відсоток досягнення повної ремісії звичайно перевищує 90%, і 5-річне виживання складає по крайній мірі 50% [11]. Хворі, яким на протязі 2,5-3 років проводилася підтримуюча терапія і не було рецидиву, мають більше 80% шансів вилікуватися від лейкозу. У дорослих можна очікувати 25% без рецидивного виживання; при використанні деяких більш агресивних режимів терапії 5-річне виживання складає 30-40% [38].
Гострий недиференційований лейкоз – діагностується у 2-3% хворих, переважно в молодому віці. Клінічно захворювання характеризується значною важкістю стану хворих, швидким прогресуванням симптоматики, вираженою анемізацією і інтоксикацією, високою температурою, геморагічними проявами, схильністю до інфекційних ускладнень [22]. Число лейкоцитів частіше знаходиться на сублейкемічному рівні, число бластних клітин в гематограмі і мієлограмі наближується до 70-80% [14].
Незважаючи на стан важкої декомпенсації, у хворих нерідко вдається отримати повні, але нетривалі ремісії (3-4 міс.). Середня тривалість життя хворих на гострий недиференційований лейкоз складає 8,90,9 міс., як і при ГМЛ. Хворі частіше помирають в результаті прогресування основного захворювання і приєднання інфекційних ускладнень [9].
У дорослих 80% гострого лейкозу складають мієлобластний і мієломонобластний варіанти, у дітей до 90% випадків припадає на ГЛЛ [30].
Патогенетичні, клінічні і морфологічні характеристики хронічного лімфолейкозу.
Хронічний лімфолейкоз (ХЛЛ) – хвороба, в основі якої лежить лімфоїдна гіперметаплазія кровотворних органів, яка часто супроводжується лімфоїдною інфільтрацією інших органів і тканин. Уражає людей в віці 25-78 років [40].
ХЛЛ являє собою злоякісну проліферацію малих лімфоцитів з тенденцією до накопичення їх в кістковому мозку, периферичній крові, лімфовузлах, селезінці і печінці. Це захворювання з повільним перебігом, тривалість якого вимірюється роками [38].
Лейкоз з хронічним перебігом – лімфопроліферативне захворювання. Субстратом пухлини є підвищене утворення морфологічно зрілих лімфоцитів. Це – В-лімфоцити, інколи Т-лімфоцити, О-лімфоцити. Лімфоцити функціонально неповноцінні, що проявляється в порушенні імунної системи, підвищеної схильності до аутоімунних реакцій та інфекціно-септичних захворювань [39].
Хоча в рідких випадках при ХЛЛ проліферують Т-лімфоцити, майже всі ХЛЛ розвивають з добре диференційованих В-лімфоцитів [29].
ХЛЛ – найбільш поширений вид лейкемії, який складає 30% всіх випадків. Розповсюдженість складає 3,9 і 2,0 на 100 000 чоловіків і жінок відповідно. Дев’яносто відсотків хворих старше 50 років, але в окремих випадках захворювання виникає у дітей [38].
Етіологія ХЛЛ невідома. Хоча безпосередній вплив спадковості не встановлений, родичі першого ступеню рідства хворих з ХЛЛ мають в 3 рази більший, ніж в решта популяції, ризик розвитку ХЛЛ і інших лімфоїдних пухлин. Участь радіації і вірусів в розвитку ХЛЛ не виявлено [25].
Патогенетичні особливості ХЛЛ – це відсутність ознак пухлинної прогресії, тому його відносять до доброякісних лейкозів. Характерні особливості:
- немає вираженого морфологічного атипізму, пухлинна клітина зустрічається рідко, в основному при волосатоклітинному лімфолейкозі, який протікає злоякісно;
- немає хромосомних аномалій;
- відсутній зв’язок з мутагенними факторами;
- хвороба розвивається в певних етнічних групах (крайньо низька захворюваність ХЛЛ у японців, китайців. малайців; євреї хворіють частіше, ніж люди білої раси); має спадково-сімейний характер;
- частіше хворіють чоловіки (68,4%); ХЛЛ – захворювання похилого і старечого віку [29].
При ХЛЛ розрізняють два великих синдроми: лімфопрогіферативний та синдром ускладнень.
1. Лімфопроліферативний, зумовлений лімфаденопатією (поліаденією, спленомегалією та лімфоїдною проліферацією кісткового мозку):
а) загальні симптоми, зумовлені інтоксикацією, розростанням лейкозних клітин в кістковому мозку, в селезінці (свербіння шкіри. лихоманка, пітливість, болі в кістках, селезінці, печінці);
б) збільшення селезінки і печінки;
в) лейкемічні інфільтрати в шкірі – лейкеміди;
г) симптоми стиснення, пов’язані із збільшенням регіонарних лімфатичних вузлів;
д) характерні зміни в кістковому мозку і периферійній крові.
2. Синдром ускладнень:
а) гнійно-запальні;
б) аутоімунні (гемолітична анемія).
Приблизно у 25% хворих захворювання протікає безсимптомно і виявляється випадково при огляді чи лабораторному дослідженні [40].
В розвитку клінічних і гематологічних особливостей ХЛЛ розрізняється три періоди:
початковий період з мало вираженими гематологічними ознаками;
період розгорнутої клініко-гематологічної картини захворювання;
період прогресування дистрофічних змін, який характеризується кахексією і анемізацією.
ХЛЛ може протікати з повільним наростанням клініко-гематологічних явищ чи з їх швидким прогресуванням. Приблизно в 60% випадків спостерігається повільний перебіг захворювання [10].
В більшості випадків для ХЛЛ характерний поступовий початок і тривалий латентний перебіг. Хворі на протязі ряду років не підозрюють про існування хвороби, не дивлячись на наявність характерних змін крові. Тому нерідко захворювання виявляється зовсім випадково.
У деяких людей початковий період ХЛЛ характеризується нормальною величиною лімфатичних вузлів, які збільшуються при будь-якій інфекції (грип, ангіна) і при одужанні знову зменшуються до норми, а у інших – збільшенням лімфатичних вузлів (шийних, пахових) при відсутності суб’єктивних порушень і повному збереженні працездатності хворого. Початковий період триває до 8-10 років.
Другий період ХЛЛ характеризується генералізованим збільшенням лімфатичних вузлів (поширюється на середостіння, черевну порожнину), селезінки і печінки. Поступово розвивається загальна інтоксикація організму з підвищенням температури, пітливістю, загальною слабкістю, болями в кістках, шкірним зудом. Ці явища пов’язані із збільшенням руйнування лейкоцитів і наводненням організму продуктами нуклеїнових сполук, з лейкемічною інфільтрацією кісткового мозку. В цьому періоді звичайно виникає анемія (Ф.Е.Файнштейн, А.М.Полянська, 1969), яка наростає при загостренні патологічного процесу і особливо виражена в кінцевому періоді [18].
При огляді хворого відмічається блідість шкіри і слизових оболонок. Іноді на шкірі з’являються неспецифічні висипання у вигляді ерітеми, кропивниці, опоясуючого лишаю. Ці зміни треба відрізняти від специфічних інфільтратів – лімфом, які спостерігаються при шкірному варіанті ХЛЛ. Лімфатичні вузли збільшені до розмірів волоського горіха або курячого яйця, рухомі і не болючі. Лише в пізнішій стадії вузли стають більш щільнішими і дещо болючими [34].
Зі сторони внутрішніх органів спостерігаються різноманітні зміни в зв’язку з розвитком в них лімфоцитарної метаплазії [40].
Кінцева або термінальна стадія характеризується різким прогресуванням дистрофічних змін у внутрішніх органах, пов’язаних з тяжкою гіпоксією і інтоксикацією. Порушення трофіки тканин приводить до розвитку некрозів в різних ділянках організму з приєднанням вторинної інфекції. Досягає високого ступеню кахексія, з’являється геморагічний діатез. Також характерна злоякісна трансформація ХЛЛ – пухлинна прогресія в гематосаркому лімфатичних вузлів. Лімфатичні вузли швидко ростуть, стають кам’янистої консистенції, стискують сусідні органи, викликають болі і набряки [14].
Головною гематологічною ознакою ХЛЛ є лімфоцитоз периферійної крові і трансформація кістково-мозкового кровотворення з перевагою лімфоцитопоезу. Відповідно до цього знижується гранулоцитопоез і поступово зменшується кількість гранулоцитів в периферійній крові [15].
Для ХЛЛ характерний абсолютний лімфоцитоз, що перевищує 15 · 109 /л на момент постановки діагноза [24].
При важкому перебігу і тривалому загостренні в крові виявляються про лімфоцити, рідше лімфобласти 50-60% - молоді форми. При звичайному перебігу до 80-85% клітин складають зрілі лімфоцити і біля 5-10% - пролімфоцити [3].
Майже постійною ознакою ХЛЛ є поява в периферійній крові напівзруйнованих ядер лімфоцитів – тіней Гумпрехта-Боткіна чи клітин лейколізу, які утворюються в процесі приготування мазка крові. На початку захворювання в периферійній крові про лімфоцитів і лімфобластів немає [2].
Патологічний клон при ХЛЛ представлений В-лімфоцитами, рідше Т-лімфоцитами. Прогресування хвороби пов’язане із збільшенням кількості клітин патологічного клону [20].
В початковій стадії, а також при повільно прогр6есуючій формі ХЛЛ число лейкоцитів не перевищує 40-60х109 /л, але може бути і значним; в цьому випадку кров набуває зеленуватий (“піоїдний”) відтінок [10].
Лейкоцитарна формула характеризується лімфоцитозом: нерізким 40-45% на початку хвороби і майже тотальним 90-98% в розгорнутій стадії ХЛЛ. В зв’язку з різким лімофцитозом відносний (відсотковий) вміст гранулоцитів знижується [15].
Прискорення ШОЕ спостерігається постійно.
В кістковому мозку спостерігається тотальне заміщення мієлоїдної тканини лімфатичними елементами, що приводить до розвитку нормо-чи гіперхромної анемії і тромбоцитопенії. На ранньому етапі анемія і тромбоцитопенія не розвивають. По мірі прогресування хвороби тромбоцитопенія стає більш вираженою і стійкою, що приводить до розвитку геморагічного діатезу [3].
Виліковування ХЛЛ до останнього часу не спостерігалося. В окремих випадках комплексна хіміотерапія давала можливість отримати багаторічні ремії – від декількох місяців до 2-3 десятиліть, в середньому 75 місяців [16].
Оскільки ХЛЛ – захворювання головним чином похилого віку, то 30% смертельних випадків не пов’язано з основним захворюванням, 50% летальності викликано інфекціями, 15% - ускладненнями терапії, решта 5% - геморагіями, гемолізом чи інфільтрацією життєво важливих органів [38].
Розрізняють такі форми ХЛЛ на основі клінічних і морфологічних ознак:
1. Доброякісна.
2. Прогресуюча (класична).
3. Пухлиноподібна.
4. Спленомегалічна.
5. Кістково мозкова.
6. Ускладнена цитолізом.
7. Пролімфоцитарна.
8. Хронічний лімфолейкоз з парапротеїнемією.
9. Волосатоклітинна.
10. Т-форма хронічного лімфолейкозу [14].
Особливості проявів хронічного мієлолейкозу в клітинах кісткового мозку і периферійній крові.
Хронічний мієлолейкоз (ХМЛ) – мієлопроліферативне захворювання, що характеризується клональною проліферацією ранньої стовбурової клітини, яка звичайно приводить до збільшення числа гранулоцитів [38].
В основі хронічного мієлоїдного лейкозу лежить мієлоїдна гіперплазія кісткового мозку в основному за рахунок незрілих гранулоцитів і мієлоїдна метаплазія селезінки, печінки, лімфатичних вузлів та інших органів. порушення гематопоезу при цьому зводиться до посиленої проліферації і гальмування процесів дозрівання гранулопоетичних елементів, в результаті чого пригнічується функція інших ростків кісткового мозку, зокрема еритропоезу [18].
ХМЛ – це пухлина, що виникає з ранніх клітин-попередників мієлопоезу, які диференціюються до зрілих форм. Клітинний субстрат лейкозу становлять гранулоцити, в основному, нейтрофіли.
Захворювння проходить дві стадії:
розгорнуту доброякісну (моноклонову);
термінальну, злоякісну (поліклонову).
ХМЛ виникає в віці 30-70 років, частіше у чоловіків. Діти хворіють рідко. Починаючи з 30-річного віку захворюваність зростає. Серед всіх форм лейкозу на долю ХМЛ припадає 21,8% випадків [29]. Зустрічається у 2% дітей, хворих на лейкемію [21].
В 86-95% хронічного мієлолейкозу наявна Філадельфійська (‘Ph) хромосома, яка є в усіх клітинах кісткового мозку, крім лімфоцитів [29]. В 1960 р. філадельфійські автори Nowell і Hungerford встановили, що при ХМЛ замість нормальної хромосоми з 22 пари є хромосома з вкороченим довгим плечем, за рахунок втрати частини його хромати нової речовини. Ця ознака є високо специфічною для ХМЛ і практично не зустрічається ні при якому іншому захворюванні. При ХМЛ філадельфійська хромосома виявляється постійно, починаючи з ранніх стадій хвороби, і зберігається навіть в періоді повної ремісії [10].
Клінічно виділяють два великі синдроми:
1. Мієлопроліферативний, що зумовлений мієлоїдною інфільтрацією кісткового мозку:
-загальні симптоми, викликані інтоксикацією, розростанням лейкозних клітин в кістковому мозку, селезінці, печінці;
-збільшення печінки і селезінки;
-характерні зміни в кістковому мозку та периферійній крові.
2.Синдром, зумовлений ускладненнями:
а)геморагічний діатез, геморагії, тромбози;
б) гнійно-запальні зміни, зумовлені зниженням активності імунітету (пневмонії, плеврити, гнійні ураження шкіри);
в) сечокислий діатез, внаслідок розпаду гранулоцитів [29].
Клінічні прояви ХМЛ різноманітні. Захворювання може розвинутися як в 15, так і в 80 років. Біля 40% хворих в момент постановки діагнозу не мають ніяких клінічних симптомів. У 20% хворих спостерігається гепатоспленомегалія, у 54% тільки спленомегалія. приблизно у 50% хворих захворювання починається з анемії (Нв <120 г/л), майже у 60% - з гіперлейкоцитозу, число лейкоцитів> 100 000 мкл [38].
Перебіг захворювання можна умовно поділити на три стадії: початкову, розгорнутих клінічних проявів, термінальну.
Початкова стадія – поява патологічного клітинного клону з специфічним маркером – ‘Ph хромосомою – може перебігати безсимптомно, і часто захворювання діагностують лише завдяки випадково зробленому аналізу крові (невеликий лейкоцитоз з нейтрофільним зсувом вліво). Рідше вже в цьому періоді хворі пред’являють різні скарги загального характеру – слабкість, втомлюваність, пітливість. Ці ознаки з’являються з наростанням лейкоцитозу [18]. Інакше цю стадію називають повільною, чи хронічною фазою ХМЛ, яка звичайно триває близько 3 років [23].
Розгорнута стадія або фаза акселерації триває 1-1,5 року. При відповідному лікуванні можна повернути захворювання в хронічну фазу. Характеризується маже повним заміщенням нормального мієлопоетичного ростка патологічним клоном. Характерне розростання мієлоїдної тканини в кістковому мозку з повним витісненням жиру в плоских кістках, появою кістковомозкового кровотворення в трубчастих кістках, розростання мієлоїдної тканини в селезінці, печінці. Лімфатичні вузли не уражаються. Ця стадія хвороби може мати різні характеристики: рівень лейкоцитозу, ступінь збільшення селезінки і печінки [29].
Ведучим симптомом розгорнутої стадії є збільшення селезінки, пов’язане з розвитком в ній лейкемічної тканини. Селезінка може сягати гігантських розмірів, займаючи більшу частину черевної порожнини. Менш постійний симптом – збільшення печінки. З’являються сильні болі в кістках, розвиваються щільні вогнища злоякісного розростання в шкірі, лімфатичних вузлах [10].
Термінальна стадія або фінальна фаза ХМЛ – фаза швидкої акселерації (3-6 міс) звичайно закінчується смертю. В цій стадії з’являються яскраві ознаки пухлинної прогресії [38]. Обумовлена появою нової клітинної популяції (бластних елементів, великого числа базофілів, моноцитів), яка поступово набуває рис атипізму. В цій стадії патологічне кровотворення виходить за межі кісткового мозку і органів факультативного кровотворення: метастазування бластних елементів в лімфатичні вузли, утворення бластних інфільтратів в кістках, шкірі, мозкових оболонках, внутрішніх органах [3]. Тому термінальна стадія хвороби характеризується лихоманкою, вираженою гепото- і спленомегалією, прогресуючим похуданням, анемією, геморагічним діатезом. Хворі гинуть від виснаження, крововиливів в життєво важливі органи чи вторинних інфекцій [14].
Характерним гематологічним симптомом хвороби є виражений лейкоцитоз до 10 · 109 /л і вище. Спостерігається значний рівномірний зсув лейкоцитарної формули вліво до про мієлоцитів і навіть мієлобластів. Також постійною ознакою є збільшення вмісту еозинофілів і базофілів [19].
Внаслідок пригнічення функціонально здорових ростків кровотворення розвивається анемія і тромбоцитопенія (500-600 · 109 /л) [2].
В кістковому мозку переважають бластні клітини – від 10-20% до тотальної бластної метаплазії. Гематологічні зміни в термінальній стадії проявляються бластним кризом: це збільшення бластів в кістковому мозку і в крові. Нагадує гострий лейкоз.
Лейкоцитоз, анемія, збільшення чи зменшення кількості тромбоцитів, більш високий відсоток бластних клітин в крові і кістковому мозку відносяться до несприятливих прогностичних ознак [3].
Тривалість захворювання складає близько 7 років. Медіана виживання складає 3 роки і тільки 20% хворих живуть на протязі 5 років [38].
Статева приналежність пацієнта суттєво впливає на перебіг і проноз гемобластозів. Проведена оцінка впливу статі на перебіг ХМЛ.
У жінок хронічна фаза ХМЛ протікає з більш вираженим лейкоцитозом, тромбоцитозом і спленомеганією, ніж у чоловіків. Крім того, для жінок, на відміну від чоловіків, характерна наявність схильності до анемії в цій фазі захворювання. ХМЛ у жінок протікає з більшим об’ємом пухлинної маси, ніж у чоловіків. Більша тривалість життя чоловіків (44 міс. і 42 міс відповідно) показує, що ХМЛ у жінок протікає менш сприятливо. Лейкоцитоз, тромбоцитоз, виражена спленомегалія, анемія виявлені при встановленні діагнозу відносяться до несприятливих прогностичних ознак, пов’язаних з тенденцією до зниження тривалості життя [23].
ІІ. МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕНЬ.
2.1. Умови, об’єкти і методика експерименту.
Проведені дослідження мали на меті вивчення особливостей патологічного впливу гострого і хронічного лейкозів на систему кровотворення організму людини, на динаміку показників стану гемопоезу.
В якості об’єктів дослідження спостерігалася група людей різного віку і статі, хворих на гострий і хронічний лейкози.
Досліди проводилися в лабораторних умовах клінічної лабораторії Коломийського онкодиспансеру.
Досліджували капілярну, периферійну кров, яку брали для клінічного аналізу. Загальний клінічний аналіз крові включає: визначення концентрації гемоглобіну, швидкості осідання еритроцитів. підрахунок кількості клітин в 1 л крові, визначення кольорового показника, а також вивчення морфологічних особливостей клітин в фарбованих препаратах з підрахунком лейкограми.
Забір крові хворим проводився натще, о восьмій годині ранку за загальноприйнятим методом.
Для визначення концентрації гемоглобіну візуальним методом користувалися гемометром Салі. При змішуванні крові з соляною кислотою гемоглобін перетворюється в солянокислий гематин. При цьому червонуватий колір рідини переходить в коричнюватий (бурий). Розчин розвели до кольору стандарту, який відповідає певній концентрації гемоглобіну. В нормі концентрація гемоглобіну 120-140 г/л.
Для визначення концентрації гемоглобіну також можна користуватися гемоглобінцианідним методом. при цьому кров змішується з трансформуючим розчином – дослідна проба – і вимірюється на фотоколориметрі проти “холостої” проби. Вміст гемоглобіну розраховується згідно калібровочному графіку, побудованому по стандартному розчину гемоглобінцианіда, чи по формулі:
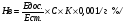 , де
, де
Едос. і Ест. – екстинкція дослідної проби і стандартного розчину;
С – концентрація гемоглобіну в стандартному розчині, мг %;
К – коефіцієнт розведення крові;
0,001 – коефіцієнт для перерахунку мг % в г % ( 1 г на 100 мл крові).
Для визначення швидкості осідання еритроцитів (ШОЕ) користувалися капіляром і штативом Панченкова. Кров з цитратом натрію набирали в капіляр і залишали на 1 годину в штативі Панченкова в вертикальному положенні, після чого по поділкам капіляра визначали величину стовпчика плазми, який відстоявся. ШОЕ виражається в мм за 1 годину. Норма для жінок – 2-15 мм/год, для чоловіків – 1-10 мм/год.
Для визначення кількості еритроцитів в 1 л крові використовували метод підрахунку еритроцитів в 1 мкл крові з цитратом натрію при постійному її розведенні і певному об’ємі лічильної камери Горяєва. Підраховуються еритроцити в 5 великих квадратах, розкреслених на 16 малих, розміщених по діагоналі.
Кількість еритроцитів в 1 мкл крові визначали по формулі:
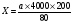 , де
, де
Х – кількість еритроцитів в 1мкл крові;
а – кількість еритроцитів в 80 малих квадратах (15х16=80);
80 – кількість підрахованих малих квадратів;
200 – ступінь розведення крові;
4000 – множник, що приводить результат до об’єму 1 мкл крові, виходячи з об’єму малого квадрату – 1/4000 мкл.
Практично, кількість еритроцитів, підраховану в 80 малих квадратах, множать на 10000.
Норма еритроцитів в крові у чоловіків складає 4-5 Т в 1 л, у жінок – 3,9-4,7 Т в 1 л.
Для визначення кількості лейкоцитів в 1 л крові використовували метод підрахунку лейкоцитів 1 мкл крові з оцтовою кислотою при постійному її розведенні і певному об’ємі лічильної камери Горяєва. Підраховується лейкоцити в 100 великих квадратах, що відповідають 1600 малих.
Кількість лейкоцитів в 1 мкл крові визначали по формулі:
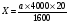 , де
, де
Х – кількість лейкоцитів в 1 мкл крові;
а – кількість лейкоцитів, підрахованих в 100 великих квадратах;
1600 – кількість малих квадратів;
20 –ступінь розведення крові;
4000 – множник, що приводить результат до об’єму 1 мкл крові. виходячи з об’єму малого квадрату – 1/4000 мкл.
Практично кількість лейкоцитів, підраховану в 1600 малих квадратах множили на 50, а для переводу в одиниці СІ (г в л), отриману цифру множили ще на 10.
В нормі кількість лейкоцитів коливається від 4 до 9 Г в 1 л. Вміст лейкоцитів менше 4 Г в 1 л свідчить про лейкопенію, більше 9 Г в 1 л – про лейкоцитоз.
Для визначення кількості тромбоцитів в 1 л крові використовували метод підрахунку тромбоцитів в 1 мкл крові при постійному її розведенні оксалатом амонію в певному об’ємі лічильної камери Горяєва з використанням фазово-контрастного приладу. Підраховуються тромбоцити в 25 великих квадратах.
Кількість тромбоцитів в 1 мкл крові визначали по формулі:
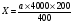 , де
, де
Х – кількість тромбоцитів в 1 мкл крові;
а – кількість тромбоцитів, підрахованих в 400 малих квадратах;
400 – число підрахованих малих квадратів;
200 – ступінь розведення крові;
4000 – множник, що приводить результат до об’єму 1 мкл крові, виходячи з об’єму малого квадрату – 1/4000 мкл.
Практично підраховану кількість тромбоцитів в 400 малих квадратах множили на 2000, а для переводу в одиниці СІ (г в л), отримали цифру множили ще на 106.
В нормі у дорослих кількість тромбоцитів в крові складає 180-320 Г/л.
ІІІ. РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯ.
Характерною особливістю лейкозів є зміна основних біохімічних показників периферійної крові і розподіл хворих за віком і статтю, в залежності від форми і ступеня важкості захворювання. Про це свідчать дані таблиць.
Таблиця 1.
Визначення характеру розподілу хворих за віком і статтю в залежності від форми лейкозу.
Діагноз
Стать
Кількість хворих
Вік в роках
до 20
20-30
30-40
40-50
50-60
60-70
70 і ст.
Хронічний
лімфоїдний
лейкоз
чол.
14
-
-
1
-
2
8
3
жін.
4
-
-
-
1
1
3
4
Хронічний
мієлоїдний
лейкоз
чол.
5
-
-
1
1
2
1
-
жін.
4
-
-
-
1
-
2
1
Гострий лімфобластний лейкоз
чол.
5
2
2
-
1
-
-
-
жін.
6
3
2
-
-
1
-
-
Гострий мієлобластний лейкоз
чол.
8
-
2
-
3
2
1
-
жін.
7
-
-
1
3
2
1
-
Нами спостерігалася група з 58 хворих, які числяться на диспансерному обліку з діагнозами: хронічний лімфоїдний лейкоз, хронічний мієлоїдний лейкоз, гострий лімфобластний лейкоз і гострий мієлобластний лейкоз. Можна відзначити характерний розподіл хворих по статі і віку, в залежності від виставленого і підтвердженого діагнозу.
По виявлених даних різниця в кількості 14 і 9 випадків між чоловіками і жінками при хронічному лімфоїдному лейкозі свідчить про те, що серед пацієнтів з типовим варіантом хвороби переважають чоловіки. У хворих в віці 30-40 років хронічний лімфоїдний лейкоз виявляється в 1 випадку, що складає 8,5 %. Звертає увагу повна відсутність хворих в віці до 30 років. Це свідчить про те, що в молодому віці від 20 до 30 років хронічний лімфоїдний лейкоз зустрічається як виняток, а в дитячому віці взагалі не спостерігається. Результати наших досліджень показали, що максимум захворюваності відмічається у людей похилого віку. В 14 хворих, що складає 65-70% даний діагноз вперше був встановлений між 50 і 70 роками.
За отриманими даними, з 9 хворих – 5 чоловіків і 4 жінки – хронічний мієлоїдний лейкоз з однаковою частотою зустрічається серед чоловіків і жінок, практично не діагностується в дитячому і юнацькому віці. На хронічний мієлоїдний лейкоз хворіють переважно люди в віці від 30 до 70 років – за нашими даними 9 випадків.
В результаті дослідження виявлено особливості гострого лімфобластного лейкозу. Чоловіки і жінки хворіють з однаковою частотою, за нашими даними 5 чоловіків і 6 жінок; зустрічається найчастіше серед дітей – 4 випадки, і переважає в юнацькому віці – 5 випадків з 9. У дорослих зустрічається рідше – 2 випадки з 11, що складає 25%.
Також в процесі досліджень виявили такі особливості: у дорослих переважає гострий мієлобластний лейкоз – до 86% (13 випадків з 15), а у дітей – гострий лімфобластний лейкоз – до 82 % (9 випадків з 11). Серед гострого лімфобластного лейкозу і гострого мієлобластного лейкозу більш поширений варіант гострого мієлобластного лейкозу, за нашими даними 15 хворих, що складає 57%. Вік більшої половини хворих (12 випадків з 15) перевищує 40 років, чоловіки і жінки хворіють з однаковою частотою. Для гострого мієлобластного лейкозу характерний більш важкий перебіг, ніж для гострого лімфобластного лейкозу.
Таблиця 2.
3.2. Зміна основних біохімічних показників крові в залежності від форми і ступеня важкості захворювання.
Діагноз
Загальна кількість хворих
ШОЕ,
мм/год
Гемоглобін, г/л
Еритроцити, х 1012/л
Лейкоцити, х 109/л
Хронічний лімфоїдний лейкоз
10
15
60
2,0
13,4
7
70
2,4
23,5
22
60
1,9
20,3
10
60
2,2
25,7
18
60
2,0
61
12
70
2,2
27,9
10
60
2,0
16,7
7
54
2,0
58
40
52
1,9
46,2
23
80
3,0
23,3
Гострий мієлобластний лейкоз
10
46
50
1,7
18,3
58
52
1,8
4,2
50
48
1,6
8,5
76
50
2,0
3,8
80
60
2,1
3,4
65
54
2,0
23,4
40
50
1,8
11,1
32
60
2,2
5,2
45
60
2,0
9
34
55
1,8
10,8
Нами спостерігалася група з 20 хворих з діанозами хронічного лімфоїдного і гострого мієлобластного лейкозів. Відповідно стану хворих виявлялися зміни основних біохімічних показників периферійної крові в загальному клінічному аналізі.
З отриманих нами даних встановлено, що для хворих хронічним лімфоїдним лейкозом характерні різні цифри ШОЕ. У окремих хворих, 4 випадки з 10, ШОЕ нормальна, в межах 7-10 мм/год. При загостренні процесу відмічається підвищення ШОЕ в межах 12-23 мм/год – 5 випадків з 10, а значно прискорена ШОЕ – 40 мм/год (1 випадок) є прогностично поганою ознакою.
В ході експерименту виявили, що при хронічному лімфоїдному лейкозі повільно розвивається малокрів’я, яке явно виявляється на 3-6 рік хвороби. Гемоглобін в 8 випадках з 10 складає 60-80 г/л, а в 2 хворих – біля 50 г/л, що обумовлено редукцією еритропоезу, внаслідок лейкемічної інфільтрації кісткового мозку. Кількість еритроцитів також відповідно зменшується в межах 1,9-2,4 х 1012 /л; поступово наростає функціональна неповноцінність еритроцитів.
Лейкоцитоз при хронічному лімфоїдному лейкозі з’являється, в основному, за рахунок зрілих лімфоцитів. В 2 випадках з 10, лейкоцитоз 13,4-16,7 х 109 /л відповідає повільно прогресуючій, доброякісній формі хронічного лімфолейкозу. Значний лейкоцитоз 20,4-46 х 109/л спостерігаємо у 6 хворих в розгорнутій стадії хвороби. У цих же 6 хворих в крові виявляються тіні Гумпрехта-Боткіна, в кількості 1-2 в полі зору. При лейкоцитозі до 58 х 109 /л, в 1 випадку – кров набуває зеленуватий (піоїдний) відтінок.
За отриманими даними при гострому мієлобластному лейкозі спостерігаються особливо високі цифри ШОЕ. Значні цифри осідання до 50-80 мм/год констатуємо вже через 20-30 хв. від моменту постановки реакції – у 5 вхорих з 10. ШОЕ прискорюється в ранніх стадіях захворювання, поступово наростає по мірі розвитку хвороби і прогресування анемії – 3 випадки з 10. У 2 хворих спостерігалося прискорення ШОЕ до 30-40 мм/год внаслідок приєднання вторинної інфекції, що є прямим показом для призначення антибіотиків.
З виявлених нами даних видно, що гострий мієлобластний лейкоз супроводжується значною і постійною анемією. Анемія відмічається в 9 випадках з 10 (90%) в межах 48-60 г/л і при цьому значна 48-54 г/л в більшої половини (у 7 хворих з 10). Число еритроцитів менше 1,9-2,0 х 1012 /л спостерігається у 20% хворих – 2 випадки з 10, з гемоглобіном нижче 60 г/л, у останніх хворих коливається від 2,0 до 3,0 1012 /л. У 4-х хворих ведучими клінічними симптомами відмічалися невеликі геморагічні прояви у вигляді спонтанних синців на шкірі, непостійних ясенних і носових кровотеч. У 3-х хворих вдалося виявити можливі мієлотоксичні впливи: рентгенівське опромінення, струми зверхвисокої частоти, анілінові барвники.
Зміни числа лейкоцитів характерні в широких межах. В 4 випадках спостерігається лейкоцитоз 11,1-23,4 х 109/л, а в більшої половини хворих загальна кількість лейкоцитів або в межах норми 4,2-9 х 109 /л – у 4-х хворих. або дещо понижена 3,4-3,8 х 109 /л – у 2 хворих – лейкопенія.
Таблиця 3.
3.3. Зміна біохімічних показників крові хворих хронічним мієлолейкозом в залежності від статі.
Група хворих
(чол. і жін.)
Фаза захворювання
Еритроцити,
1012 /л
Лейкоцити,
109 /л
Тромбоцити,
109 /л
Селезінка нижче реберної дуги, см
М1
хронічна
4,01,3
101,6
390,9
4,1
М1
3,5
33,0
230
0
М1
4,2
72,0
280
1,5
М1
4,6
130,5
440
4,8
М2
прогресуюча, бластна
3,11,6
48,9
328,1
11,7
М2
2,4
13,6
70
2
М2
3,1
37,2
140
14
М2
3,6
71,0
482
20
Ж1
хронічна
3,71,8
103,2
553
6,7
Ж1
3,3
39,3
340
1
Ж1
3,8
87,5
430
4
Ж1
4,2
139,5
520
10
Ж2
прогресуюча, бластна
3,51,5
59
348
9,2
Ж2
3,2
12,3
90
1
Ж2
3,5
37
300
7
Ж2
4,0
103
525
15,8
Дослідження проводили у 16 хворих хронічним мієлолейкозом в віці від 15 до 78 років. При цьому з пацієнтів були сформовані дві групи хворих: в першу увійшли 4 чоловіка і 4 жінки з хронічною фазою захворювання, в другу – 4 чоловіка і 4 жінки з прогресуючою і бластною фазами лейкозного процесу.
У всіх хворих визначали розміри селезінки, шляхом УЗД і досліджували вміст еритроцитів, лейкоцитів і тромбоцитів в периферійній крові.
Результати дослідження занесені до таблиці, з якої видно, що при вимірюванні розмірів селезінки у чоловіків її край визначався нижче реберної дуги на 4,1 см, в той час як у жінок – 6,7 см.
В периферійній крові в хронічній фазі лейкозного процесу розподіл числа еритроцитів по підгрупам показав, що у жінок, в основному, вміст еритроцитів коливався в межах 3,5-4,0 · 1012 /л, в той час як у чоловіків цей показник знаходився в межах 4,0-4,5 · 1012 /л.
Для цієї фази лейкозного процесу для найбільшого числа чоловіків і жінок був характерний лейкоцитоз (20-50 · 1012 /л), а у другої частини хворих число лейкоцитів відрізнялось в досліджуваних групах. знаходячись для жінок в межах 100-250 · 109 /л, а для чоловіків – 70-100 · 109 /л.
Наряду з цим видно різницю при підрахунку кількості тромбоцитів периферійної крові в хронічній фазі ХМЛ. Середнє їх число суттєво відрізнялось у хворих досліджуваних груп, складаючи для чоловіків 390 · 109 /л, а для жінок – 553 · 109 /л. Розподіл даного показника в підгрупах хворих виявив, що у більшості чоловіків кількість тромбоцитів периферійної крові знаходилась в межах 200-400 · 109 /л, а у більшої частини жінок число тромбоцитів (400-600 · 109 /л) перевищувало ці величини.
В прогресуючій фазі і фазі бластного кризу середні розміри селезінки у чоловіків були в 1,3 рази більші, ніж у жінок.
Середня кількість еритроцитів серед цих хворих у жінок виявилась більша, ніж у чоловіків (3,51,5 і 3,11,6 · 1012 /л). В той же час число лейкоцитів у жінок було більше, ніж у чоловіків і складало 59,0 · 109 /л і 48,9 · 109 /л. При цьому середнє число тромбоцитів периферійної крові у особин обох статей було сходним в прогресуючій і бластній фазах лейкозного процесу (328 · 109 /л і 348 · 109 /л) відповідно.
Аналіз середньої тривалості життя також виявив різницю, пов’язану із статтю. Так, виявилось, що жінки, хворі на ХМЛ гинуть на 2 місяці раніше, ніж чоловіки. Середня тривалість життя в нашому дослідженні у жінок дорівнювала 3 р. і 6 міс., у чоловіків 3 р. і 8 міс.
Результатом проведених досліджень свідчать про те, що між сформованими по статевій ознаці групами хворих ХМЛ є помітні відмінності по цілому ряду основних клініко-гематологічних показників.
У жінок хронічна фаза ХМЛ протікає з більш вираженим лейкоцитозом, тромбоцитозом і спленомегалією, ніж у чоловіків. Крім того, для жінок, на відміну від чоловіків, характерна наявність схильності до анемії за рахунок вираженого витіснення ерітроїдного ростка кісткового мозку лейкозним клоном. ХМЛ у жінок в цілому протікає з більшим об’ємом пухлинної маси, ніж у чоловіків.
Лейкоцитоз, тромбоцитоз, спелномегалія, анемія відносяться до несприятливих прогностичних ознак, які пов’язані з низьким виживанням. Це означає, що ХМЛ в цілому у жінок перебігає менш сприятливо, ніж у чоловіків.
Таблиця 4.
3.4. Розподіл померлих по характеру захворювання і віку.
Форма захворювання
Загальне число померлих
Число померлих (абсолютне і відсот.
Вік померлих (в роках)
до 20
від 21
до 30
від 31
до 40
від 41 до 50
від 51 до 60
старше 60
Гострий лейкоз
26
абс.
4
10
7
1
3
1
%
16
38,5
24
3,9
11
3,9
Хронічний лімфоїдний лейкоз
4
абс.
-
-
-
1
2
1
%
-
-
-
25
50
25
Хронічний мієлоїдний лейкоз
12
абс.
-
2
4
1
2
3
%
-
166
33,2
8
16,6
25
При детальному аналізі 42 історій хвороби померлих хворих, які числилися на диспансерному обліку з діагнозами гострого лейкозу, хронічного лімфоїдного лейкозу і хронічного мієлоїдного лейкозу виявлено слідуючи особливості їх розподілу, в залежності від характеру захворювання і віку.
За отриманими даними при гострому лейкозі проноз найбільш несприятливий. Кількість померлих з даною формою гемобластози 26 майже вдвічі перевищує сумарну кількість померлих з хронічною мієлоїдної і хронічною лімфоїдною формами лейкозу (12 і 4). Смерть при гострому лейкозі обумовлена загостренням і прогресування лейкозного процесу. При цьому віковий розподіл свідчить, що переважна більшість хворих гине в молодому віці, до 40 років (21 з 26, що разом складає 78,5%). Середня тривалість життя хворих гострим лейкозом при сучасні терапії складає 15-18 місяців, хоча окремі хворі залишаються в ремісії декілька років, а особливо низька тривалість життя у хворих похилого віку.
В результаті дослідження виявлено, що хронічний лімфоїдний лейкоз характеризується тривалим латентним перебігом і ремісіями в середньому до 75 місяців. Дані таблиці свідчать про те, що хронічний лімфоїдний лейкоз переважно зустрічається серед людей похилого віку: вік 75% померлих (3 з 4) перевищує 50 років і відсутність померлих в віці до 40 років. Для хронічного лімфоїдного лейкозу характерна відсутність ознак пухлинної прогресії, тому його відносять до доброякісних лейкозів.
Також в процесі досліджень виявили, що при хронічному мієлоїдному лейкозі смертність починаючи з 20-річного віку зростає (7 з 12), що складає 57,8%. Також висока смертність зафіксована в віці від 50 до 70 років, про що свідчать дані таблиці (5 з 12), що складає 42,2%. Медіана виживання при хронічному мієлоїдному лейкозі складає 3 роки і тільки 20% хворих живуть на протязі 5 років. В загальному середня тривалість захворювання складає близько 7 років.
3.5. Визначення середнього арифметичного показника виживання груп хворих гострим лімфобластним і гострим мієлобластним варіантами лейкозу.
Для визначення тривалості життя певної групи хворих гострим лімфобластним і гострим мієлобластним варіантами лейкозу використовували простий спосіб оцінки виживання – вираховування середнього арифметичного показника М. Ці дані використали для статистичного порівняння двої груп по одній з клінічних ознак, відображаючи значимість цього моменту для тривалості життя однієї групи хворих в порівнянні з іншою.
Використовували графічний метод побудови кривих виживання. При побудові кривої на горизонтальній осі відкладали час в місяцях, на вертикальній – відсоткове чи абсолютне число хворих, що прожили 1, 2, 3 місяці і більше. По цій кривій визначили показник 10, 25, 50% виживання – медіану виживання.
Характер отриманої кривої дає додаткові відомості про інтенсивність летальних випадків в різні періоди часу, в залежності від певних клінічних ознак. При порівняні кривих виживання отримали значну інформацію про групи хворих гострим лімфобластним і гострим мієлобластним лейкозами.
Так, спадаючий характер кривої виживання при гострому мієлобластному лейкозі (пунктирна лінія) відображує високу смертність в перші 3 місяці захворювання: 1/3 (36%) хворих гострим мієлобластним лейкозом і 16% хворих не переживають 2 місяць хвороби. Показник 50% виживання при гострому мієлобластному лейкозі складає всього 4 з половиною місці, тобто половина хворих помирає за такий малий строк. Тільки 8% хворих живуть 12 місяців, менше 4% - 2 роки.
При гострому лімфобластному лейкозі характер кривої, що майже наближається до горизонтальної осі на першому відрізку, відображає порівняно невисоку смертність в перші місяці захворювання: за 3 місяці помирає 5% хворих, тобто в 7 разів менше, ніж за той самий час при гострому мієлобластному лейкозі. В подальшому крива нерізко знижується, вказуючи на порівняно довготривалі строки перебігу процесу у більшості хворих. Медіана виживання складає 12 місяців; у 10% хворих тривалість захворювання – 3 роки.
Велике значення має горизонтальна частина кривої виживання, яка встановлюється на рівні поверх 4 років у 8% хворих, що пережили строк захворювання, який дозволяє припустити можливість одужання. На користь цього свідчить велике число хворих гострим лімфобластним лейкозом з тривалістю захворювання більше 2 років (20%).
Порівняння характеру кривих виживання хворих гострим лімфобластним лейкозом і гострим мієлобластним лейкозом свідчить не тільки про достовірне збільшення тривалості життя хворих лімфобластним варіантом гострого лейкозу, але і про більш тривале виживання хворих, і головне, про можливість отримання тривалих ремісій, які дозволяють сподіватися на одужання 8-10% хворих, що неможливо при гострому мієлобластному лейкозі.
ВИСНОВКИ
Встановлено, що при хронічному лімфоїдному лейкозі максимум захворюваності відмічається у людей похилого віку і чоловічої статі.
Відмічено, що в дитячому віці переважає гострий лімфобластний лейкоз, у дорослих більш поширений варіант гострого мієлобластного лейкозу.
Встановлено, що в периферійній крові хронічний лімфїдний лейкоз проявляється прискоренням ШОЕ, анемією і значним лейкоцитозом, а гострий мієлобластний лейкоз – особливо високими цифрами ШОЕ, значною і постійною анемією і незначним лейкоцитозом.
Виявлено, що хронічний мієлоїдний лейкоз у жінок в цілому перебігає менш сприятливо, ніж у чоловіків, з особливо вираженим лейкоцитозом, тромбоцитозом, анемією і спленомегалією.
Встановлено, що при гострому лейкозі прогноз найбільш несприятливий, найвища смертність в молодому віці.
Зафіксовано, що при гострому лімфобластному лейкозі на відміну від гострого мієлобластного, порівняно не висока смертність в перші місяці захворювання і більш тривале виживання хворих.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
Абдулкадыров К.М., Руковицын О.А., Бессмельцев С.С., Руголь В.И. Лейкозы – болезни стромы кроветворных органов // Гематология и трансфузиология. – 1996.- Т.41, № 1. – с.13-16.
Абрамов М.Г. Гематологический атлас. – М.: Медицина, 1985. – с.48-56.
Базарнова М.А., Морозова В.Т. Руководство к практическим занятиям по клинической лабораторной диагностике. – Київ: Вища школа, 1988. – с.38-50.
Байдун Л.В. Современная диагностика и классификация острой лимфобластной лейкемии // Гематология и трансфузиология. – 1997. - №3. – с.37-43.
Байдун Л.В. Современная диагностика и классификация острой миелобластной лейкемии // Гематология и трансфузиология. – 1996. – Т.41, №4. – с.35.
Балакирев С.А. Особенности лейкозов у детей раннего возраста // Российский медицинский журнал. – 1996. - №1.- с.55.
Барышников А.Ю. Актуальные вопросы диагностики и лечения новообразований крови и лимфатических тканей у детей. – М.: Медицина, 1983. – с.44-46.
Барышников А.Ю., Байдун Л.В., Ленская Р.В. Критерии диагностики Т-клеточного варианта острого лимфобластного лейкоза // Гематология и трансфузиология. – 1990. – Т.35, №4. – с.27-29.
Бергольц В.М., Кисляк Н.С., Еремеев В.С. Иммунология и иммунотерапия лейкоза. – М.: Медицина, 1978. – с.3-4.
Блохин Н.Н., Петерсон Б.Е. Клиническая онкология. – М.: Медицина, 1979. – с.242-295.
Богачева Н.Ю., Масчан А.А., Литвинов Д.В., Логинов А.В., Байдун Л.В. Гипопластический дебют острого лимфообластного лейкоза у детей: клинико-лабораторные характеристики // Российский вестник перинатологии и педиатрии. – 1997. – Т.42, №2. – С.12-15.
Бриллиант М.Д., Воробьев А.И., Гогин Е.Е. Отдаленные исследования действия малых доз ионизирующей радиации на человека // Терапевтический архив. – 1988. - №6. – с.3-6.
Виговська Я.І., Качоровський Б.В., Мазурак Г.А., Лукавецький Л.М., Орлик В.В., Пшеничний І.С. Показники смертності від гемобластозів у Рівненській області до і після аварії на ЧАЕС // Терапевтичний архів. – 1990. – Т.62, №7. – с.129-132.
Воробьев А.И. Руководство по гематологии. – М.: Медицина, 1985. – с.181-284.
Гаврилов О.К., Козинец Г.И., Черняк Н.Б. Клетки костного мозга и периферической крови. – М.: Медицина, 1985. – с.123-128.
Гарин А.М., Сыркин А.Б., Бычков М.Б. Противоопухолевая терапия. – М.: Медицина, 1986. – с.101-107.
Горднюк Н.М., Войко Г.Г. Случай проявления острого лимфообластного лейкоза в области лица // Стоматология. – 1993. – Т.72, №1. – с.84-85.
Даштаянц Г.А. Клиническая гематология. – Київ: Здоров’я, 1978. – с.97-144.
Жербин Е.А., Чухловин А.Б.Радиационная гематология. – М.: Медицина, 1989. – с.3-8.
Калетин Г.И., Волкова М.А., Рындин В.Д. Сочетание хронического лимфолейкоза с другими злокачественными новообразованиями // Терапевтический архив. – 1990. – Т.62, №7. – с.129-132.
Кіцера Н.І., Поліщук Р.С., Козій Р.О., Сіренко А.Г. Цитогенетичний та клініко-генеалогічний аналіз хронічної мієломоноцитарної лейкемії у дитини // Лікарська справа. – 1999. - №1. –с.129-131.
Ковалева Л.Г. Острые лейкозы. – М.: Медицина, 1990. – 272 С.
Коваль А.И., Третяк Н.Н. Клинико-морфологическая характеристика миелоидных лейкозов в современных экологических условиях Украины // Лікарська справа. – 1998. - №1. – с.18.
Комаров Ф.И., Хазанов А.И. Болезни органов пищеварения и системы крови. – М.: Медицина, 1992. – с.365-400.
Лазарев И.М. Опухоли лимфатических узлов. – Кишинев: Штиница, 1990. – с.25-27.
Минаков В.Н., Ковтунова М.Е., Новосадов В.М. Биохимические и цитохимические критерии прогнозирования течения острого лимфобластного лейкоза у детей // Гематология и трансфузиология. – 1991. – Т.36, №10. – с.7-10.
Михальченко Б.В., Портянко Н.М., Терещенко В.П. Актуальные проблемы ликвидации медицинских последствий аварии на Чернобыльской АЭС. – Київ: Здоров’я, 1992. – с.150.
Морозова В.Т. Лейкозы – болезни стромы кроветворных органов // Клиническая лабораторная диагностика. – 1999. - №6. – с.3-13.
Нейко Є.М., Боцюрко В.І. Внутрішні хвороби. – Коломия: Вік, 1997. – с.447-453.
Оленская А.Н., Рахмонова О.Д., Исеева И.И. Клинико-гематологические паралели при остром лимфобластном лейкозе у взрослых // Здравоохранение Таджикистана. – 1990. - №5. – с.48-52.
Песоцкая Л.А. Острый лейкоз у взрослых // Врачебное дело. – 1992. - №9. – с.84.
Песоцкая Л.А. Динамика показателей состояния гемопоэза у больных острым лимфобластным лейкозом // Лікарська справа. – 1998. - №1. – с.101.
Поляков В.Е. Острый лейкоз у детей // Фельдшер и акушерка. – 1991. - №6. – с.27-32.
Потоцкий И.И. Заболевание кожи при лейкозах. – Київ: Здоров’я, 1978. – с.25-32.
Ряузова Л.Ю., Яворковский Л.И., Соловей Д.Я. Патогенез, диагностика и лечение миелодисплазий. – Рига, 1987. – с.45-46.
Суслова Т.А., Берлинсон М.Я., Жуковская Е.В., Русанова Н.Н. Прогностические факторы в развитии и течении острого лимфобластного лейкоза у детей // Педиатрия. – 1991. - №1. – с.108-109.
Терещенко В.П., Нечваленко Е.И., Жежера В.Н. Актуальные проблемы ликвидации медицинских последствий аварии на Чернобольской АЭС. – К.: Здоров’я, 1992. – с.219.
Токарев Ю.Н., Бухна А.Е. Секреты гематологии и онкологии. – М.:Бином, 1997. – с.235-248.
Файнштейн Ф.Е., Козинец Г.И., Бахрамов С.М., Хохлова М.П. Болезни системы крови. – Ташкент: Медицина, 1987. – с.184-196.
Файнштейн Ф.Е., Хохлова М.П., Полянская А.М., Макеева Р.А. Дискуссионные вопросы классификации злокачественных лимфопрлиферативных заболеваний // Гематология и трансфузиология. – 1985. - №6. – с.3-6.
Хомченковскийкий Е.И. Экспериментальная химиотерапия лейкозов. – М.: Медицина, 1980. – с.3-5.
Шехтман М.М. Гемобластозы у беременных // Акушерство и гинекология. – 1998. - №3. – с.52.